
摘要
本发明属于有机合成技术领域,具体公开了一种O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法。所述合成方法包括如下步骤:将羟胺溶液与甲基异丁基酮加热反应得到甲基异丁基酮肟,然后将甲基异丁基酮肟与1,3 ?二氯丙烯、碱液反应,反应结束后,反应液用酸调节至弱酸性,分相,水相用甲基异丁基酮萃取,合并有机相,水洗后除去水,回收甲基异丁基酮后得到产品0 ? (3 ?氯 ?2 ?丙烯基)羟胺。本发明中,甲基异丁基酮同时作为氨基保护剂和溶剂,反应前后分子结构未发生变化,能克服传统工艺消耗大量乙酸乙酯并副产醋酸和氯化钠的缺点,本发明是一种高效、环保、高收率的0 ? (3 ?氯 ?2 ?丙烯基)羟胺合成方法,适合于工业化生产。
权利要求书
1.一种O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法,其特征在于,包括如下步骤:将羟胺溶液与甲基异丁基酮加热反应得到甲基异丁基酮肟,然后将甲基异丁基酮肟与1,3 ?二氯丙烯、 碱液反应,反应结束后,反应液用酸调节至弱酸性,分相,水相用甲基异丁基酮萃取,合并有 机相,水洗后除去水,回收甲基异丁基酮后得到产品0 ? (3 ?氯 ?2 ?丙烯基)羟胺。
2.根据权利要求1所述的合成方法,其特征在于:将羟胺溶液与甲基异丁基酮预热后分 别泵入第一级微通道反应器中,反应得到甲基异丁基酮肟,然后微通道反应器流出的反应 液直接进入第二级微通道反应器中,与1,3 ?二氯丙烯、液碱继续反应,反应结束后,反应液 用酸调节至弱酸性,分相,水相用甲基异丁基酮萃取,合并有机相,水洗后除去水,回收甲基 异丁基酮后得到产品0 ? (3 ?氯 ?2 ?丙烯基)羟胺。
3.根据权利要求1或2所述的的合成方法,其特征在于:所述羟胺溶液的制备方法为:将 羟胺盐的水溶液通过碱性离子交换树脂处理得到羟胺溶液。
4.根据权利要求3所述的的合成方法,其特征在于:所述羟胺盐为盐酸羟胺或硫酸羟胺。
5.根据权利要求1所述的的合成方法,其特征在于:所述甲基异丁基酮与羟胺的摩尔比 为1.1 ?2.0∶1。
6.根据权利要求1所述的的合成方法,其特征在于:所述1,3 ?二氯丙烯与羟胺的摩尔比 为1.1 ?2.0∶1。
7.根据权利要求1所述的的合成方法,其特征在于:所述碱液为氢氧化钠水溶液或氢氧 化钾水溶液。
8.根据权利要求7所述的的合成方法,其特征在于:所述氢氧化钠水溶液或氢氧化钾水 溶液的质量分数为10 ?30%。
9.根据权利要求1所述的的合成方法,其特征在于:所述羟胺溶液与甲基异丁基酮反应 得到甲基异丁基酮肟的反应温度控制在20 ?100℃;
和/或,所述甲基异丁基酮肟与1,3 ?二氯丙烯、碱液反应的反应温度控制在50 ?90℃。
10.根据权利要求1所述的的合成方法,其特征在于:除去水的方式为共沸除水。
说明书
技术领域
[0001] 本发明涉及有机合成技术领域,特别是涉及一种农药药中间体O ? (3 ?氯 ?2 ?丙烯 基)羟胺的合成方法。
背景技术
[0002] O ? (3 ?氯 ?2 ?丙烯基)羟胺(氯代胺)属烷氧基胺类化合物,该类化合物是用途广泛 且价格昂贵的有机合成中间体。烷氧基胺类化合物可用作烷基胺基化试剂,在有机合成和 新药生产中引入烷氧基胺基团到酮类化合物(特别是甾族化合物),可用作药物生产的中间 体,也可作合成新医药和新农药创制领域的中间体,O ? (3 ?氯 ?2 ?丙烯基)羟胺是烯草酮的重 要中间体,还能被广泛用于合成其它环己烯酮肟类除草剂,如吡哺草酮(Tepraloxydim)、噻 草酮 (Cyc loxyd im)、苯草酮 (Tra lkoxyd im)、丁苯草酮 (Butroxyd im)、环苯草酮
(Clefoxidim)等。该类除草剂是ACCase抑制剂,是一种芽后选择性除草剂,对于大多数一年 生和多年生的禾本科杂草有特效。
[0003] 
[0004] 目前,文献中报道的O ? (3 ?氯 ?2 ?丙烯基)羟胺合成方法主要有以下几种:
[0005] 路线一:以乙醇、乙腈为起始原料,反应式如下:
[0006]
[0007] 该路线具体过程为:向乙腈和无水乙醇的甲苯溶液中通入大量的氯化氢气体搅拌22h后,在 ?10℃到 ?5℃条件下滴加盐酸羟胺水溶液,搅拌直到有机层被分离,形成化合物乙 酰羟肟酸乙酯,产率93.9%。再以四丁基溴化铵为相转移催化剂,与1,3 ?二氯丙烯反应得到 O ? (3 ?氯 ?2 ?丙烯基)羟胺,产率87 .5%。此方法会用到大量氯化氢气体,污染和腐蚀都很严 重;而且需要用到比较贵的相转移催化剂,从成本和环保方面均不利于工业化。
[0008] 路线二:以N ?羟基邻苯二甲酰亚胺为起始原料,反应式如下:
[0009]
[0010] 该路线具体过程为:N ?羟基邻苯二甲酰胺和1,3 ?二氯丙烯在二甲基亚砜为溶剂发生烷基化反应得到产物2 ? (3 ?氯烯丙氧基)异氮茚 ?1,3 ?二酮,这一步反应操作简单,在常温 下就能得到高产率的产物。将2 ? (3 ?氯烯丙氧基)异氮茚 ? 1,3 ?二酮溶于乙醇后加胼升温回 流,然后过滤,滤液蒸馏,甲醇重结晶得到O ? (3 ?氯 ?2 ?丙烯基)羟胺。该方法用到的起始原料N ?羟基邻苯二甲酰亚胺合成过程复杂,且反应过程中副产物多,难以工业化。
[0011] 路线三:以乙酸乙酯为起始原料,反应式如下:
[0012]
[0013] 该路线具体过程为:由乙酸乙酯、盐酸羟胺在NaOH水溶液中常温反应lh,随后滴加1,3 ?二氯丙烯,在60℃搅拌回流2.5h,冷却至室温,静止分层,收集上层有机相,用无水硫酸 镁干燥后减压脱除溶剂,即得到N ?乙酰基 ?O ? (3 ?氯 ?2 ?丙烯基)羟胺;再将N ?乙酰基 ?O ? (3 ? 氯 ?2 ?丙烯基)羟胺溶于适量乙醇,加入35%工业盐酸在50℃剧烈搅拌反应后减压脱除溶剂 乙醇, 用28%NaOH水溶液调节至pH=9, 用乙酸乙酯萃取3次,收集上层有机相,无水硫酸镁 干燥后减压脱溶,即得产物O ? (3 .氯 .2 .丙烯基)羟胺。该合成方法操作相对较为繁琐,反应 后的溶剂乙酸乙酯中含有大量副产物乙醇,使得溶剂回收较为困难;同时,该方法会消耗大 量的乙酸乙酯,并副产醋酸和氯化钠,三废量大;而且,上述反应均在反应釜或者简易管式 反应器中进行,效率较低。
[0014] 为解决乙酸乙酯路线的缺点,中国发明专利CN109438280A公开了一种用丙酮、盐 酸羟胺、氢氧化钠、1,3 ?二氯丙烯合成O ? (3 ?氯 ?2 ?丙烯基)羟胺的方法,但由于丙酮易溶于 水,回收能耗较高,还需要再使用有机溶剂萃取产品,能耗较高;而且,该专利中使用无水硫 酸钠干燥脱水的方式也不便于进行工业化生产。
发明内容
[0015] 鉴于以上所述现有技术的缺点,本发明的目的在于O ? (3 ?氯 ?2 ?丙烯基)羟胺的合 成方法, 用于解决现有技术中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成成本较高、生产效率低、能耗 高、三废量大、不便于工业化等问题。
[0016] 为实现上述目的及其他相关 目的,本发明提供O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方 法,包括如下步骤:将羟胺溶液与甲基异丁基酮加热反应得到甲基异丁基酮肟,然后将甲基 异丁基酮肟与1,3 ?二氯丙烯、碱液反应,反应结束后,反应液用酸调节至弱酸性,分相,水相 用甲基异丁基酮萃取,合并有机相,水洗后除去水,回收甲基异丁基酮后得到产品O ? (3 ?氯 ? 2 ?丙烯基)羟胺。
[0017] 进一步,将羟胺溶液与甲基异丁基酮预热后分别泵入第一级微通道反应器中,反 应得到甲基异丁基酮肟,然后微通道反应器流出的反应液直接进入第二级微通道反应器 中,与1,3 ?二氯丙烯、液碱继续反应,反应结束后,反应液用酸调节至弱酸性,分相,水相用 甲基异丁基酮萃取,合并有机相,水洗后除去水,回收甲基异丁基酮后得到产品O ? (3 ?氯 ?2 ? 丙烯基)羟胺。
[0018] 进一步,所述羟胺溶液的制备方法为:将羟胺盐的水溶液通过碱性离子交换树脂 处理得到羟胺溶液。
[0019] 进一步,所述羟胺盐为盐酸羟胺或硫酸羟胺。
[0020] 进一步,所述甲基异丁基酮与羟胺的摩尔比为1.1 ?2.0∶1。
[0021] 进一步,所述1,3 ?二氯丙烯与羟胺的摩尔比为1.1 ?2.0∶1。
[0022] 进一步,所述碱液为氢氧化钠水溶液或氢氧化钾水溶液。
[0023] 进一步,所述氢氧化钠水溶液或氢氧化钾水溶液的质量分数为10 ?30%。
[0024] 进一步,所述羟胺溶液与甲基异丁基酮反应得到甲基异丁基酮肟的反应温度控制在20 ?100℃。
[0025] 进一步,所述甲基异丁基酮肟与1,3 ?二氯丙烯、碱液反应的反应温度控制在50 ?90℃。
[0026] 进一步,除去水的方式为共沸除水。
[0027] 如上所述,本发明的O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法,具有以下有益效果:
[0028] 本发明的合成方法使用碱性离子交换树脂将羟胺盐水溶液处理得到羟胺溶液,能有效减少废水中盐的含量,降低废水处理成本;本发明使用甲基异丁基酮与羟胺反应,甲基 异丁基酮同时作为氨基保护剂和溶剂,反应前后分子结构未发生变化,能克服传统工艺消 耗大量乙酸乙酯并副产醋酸和氯化钠的缺点;本发明使用共沸除水工艺,不使用干燥剂除 水,因此不产生固废;本发明使用微通道反应代替传统釜式或管式反应器,能进一步提高产 品收率和品质。
[0029] 综上所述,本发明是一种高效、环保、高收率的O ? (3 ?氯 ?2 ?丙烯基)羟胺合成方法, 适合于工业化生产。
具体实施方式
[0030] 以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书 所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实 施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离 本发明的精神下进行各种修饰或改变。
[0031] 本发明提供一种O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法,包括如下步骤:
[0032] (1)将羟胺盐(盐酸羟胺或硫酸羟胺)的水溶液通过碱性离子交换树脂处理得到羟 胺溶液。反应式为:
[0033]
[0034] (2)将羟胺溶液与甲基异丁基酮预热后分别泵入第一级微通道反应器中,反应得到甲基异丁基酮肟,然后微通道反应器流出的反应液直接进入第二级微通道反应器中,与 1,3 ?二氯丙烯、液碱继续反应,反应结束后,反应液用酸调节至弱酸性,分相,水相用甲基异 丁基酮萃取,合并有机相,水洗后共沸除水,回收甲基异丁基酮后得到产品O ? (3 ?氯 ?2 ?丙烯 基)羟胺。
[0035] 反应式为:
[0036] 氨基保护:
[0037] 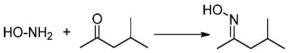
[0038] 醚化反应:
[0039]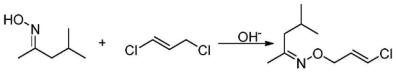
[0040] 脱保护:
[0041] 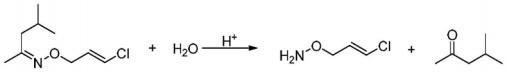
[0042] 其中,甲基异丁基酮与羟胺的摩尔比为1.1 ?2.0∶1。
[0043] 其中,1,3 ?二氯丙烯与羟胺的摩尔比为1.1 ?2.0∶1。
[0044] 其中,碱液为氢氧化钠水溶液或氢氧化钾水溶液。具体的,使用的氢氧化钠水溶液和氢氧化钾水溶液的质量分数均为10?30%。
[0045] 其中,羟胺溶液与甲基异丁基酮反应得到甲基异丁基酮肟的反应温度控制在20 ?100℃。
[0046] 其中,甲基异丁基酮肟与1,3 ?二氯丙烯、碱液反应的反应温度控制在50 ?90℃。
[0047] 以下实施例中的试剂信息如下所示:
[0048] 盐酸羟胺:CP、江苏强盛功能化学股份有限公司;甲基异丁基酮:CP、成都齐利化工;氢氧化钠:成都市科龙化工试剂厂;强碱性苯乙烯阴离子交换树脂:廊坊津南树脂有限 公司;微通道反应器:康宁。
[0049] 实施例1
[0050] 本实施例中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法包括如下步骤:
[0051] 将盐酸羟胺(70.0g,1mol)水溶液通过处理好的717强碱性苯乙烯性阴离子交换树脂,流出液室温下泵入第一级微通道反应器中,同时泵入甲基异丁基酮(150g,1 .5mol),进 行反应,反应温度控制在80 ? 100℃;第一级微通道反应器流出液直接进入第二级微通道反 应器中,并同时加入1,3 ?二氯丙烯(116 .6g,1 .05mol)、30%氢氧化钠(147g,1 .1mol)溶液, 继续反应,反应温度控制在80 ?90℃;反应结束后,分相,水相用甲基异丁基酮萃取(50mL× 3),合并有机相和萃取相,水洗后共沸除水,回收溶剂,得到O ? (3 ?氯 ?2 ?丙烯基)羟胺产品 102.4g。
[0052] 本实施例制得的O ? (3 ?氯 ?2 ?丙烯基)羟胺纯度为99.2%,收率为94.5%。
[0053] 实施例2
[0054] 本实施例中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法包括如下步骤:
[0055] 将盐酸羟胺(70.0g,1mol)水溶液通过处理好的717强碱性苯乙烯性阴离子交换树脂,流出液室温下泵入第一级微通道反应器中,同时泵入甲基异丁基酮(150g,1 .5mol),进 行反应,反应温度控制在20 ?50℃;第一级微通道反应器流出液直接进入第二级微通道反应 器中,并同时加入1,3 ?二氯丙烯(116 .6g,1 .05mol)、30%氢氧化钠(147g,1 .1mol)溶液,继 续反应,反应温度控制在50 ?60℃;反应结束后,分相,水相用甲基异丁基酮萃取(50mL×3), 合并有机相和萃取相,水洗后共沸除水,回收溶剂,得到O ? (3 ?氯 ? 2 ? 丙烯基)羟胺产品 100.8g。
[0056] 本实施例制得的O ? (3 ?氯 ?2 ?丙烯基)羟胺纯度为99.3%,收率为92.65%。
[0057] 实施例3
[0058] 本实施例中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法包括如下步骤:
[0059] 将硫酸羟胺(70.0g,1mol)水溶液通过处理好的717强碱性苯乙烯性阴离子交换树脂,流出液室温下泵入第一级微通道反应器中,同时泵入甲基异丁基酮(150g,1 .5mol),进 行反应,反应温度控制在50 ?80℃;第一级微通道反应器流出液直接进入第二级微通道反应 器中,并同时加入1,3 ?二氯丙烯(116 .6g,1 .05mol)、30%氢氧化钠(147g,1 .1mol)溶液,继 续反应,反应温度控制在70 ?80℃;反应结束后,分相,水相用甲基异丁基酮萃取(50mL×3), 合并有机相和萃取相,水洗后共沸除水,回收溶剂,得到O ? (3 ?氯 ? 2 ? 丙烯基)羟胺产品 101.9g。
[0060] 本实施例制得的O ? (3 ?氯 ?2 ?丙烯基)羟胺纯度为99.5%,收率为94.0%。
[0061] 实施例4
[0062] 本实施例中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法包括如下步骤:
[0063] 将硫酸羟胺(164.15g,1mol)水溶液通过处理好的717强碱性苯乙烯性阴离子交换树脂,流出液室温下泵入第一级微通道反应器中,同时泵入甲基异丁基酮(150g,1 .5mol), 进行反应,反应温度控制在80 ? 100℃;第一级微通道反应器流出液直接进入第二级微通道 反应器中,并同时加入1,3 ?二氯丙烯(116 .6g,1 .05mol)、30%氢氧化钠(147g,1 .1mol)溶 液,继续反应,反应温度控制在80 ?90℃;反应结束后,分相,水相用甲基异丁基酮萃取(50mL ×3),合并有机相和萃取相,水洗后共沸除水,回收溶剂,得到O ? (3 ?氯 ?2 ?丙烯基)羟胺产品 103.5g。
[0064] 本实施例制得的O ? (3 ?氯 ?2 ?丙烯基)羟胺纯度为99.8%,收率为95.5%。
[0065] 实施例5
[0066] 本实施例中O ? (3 ?氯 ?2 ?丙烯基)羟胺的合成方法包括如下步骤:
[0067] 将硫酸羟胺(164.15g,1mol)水溶液通过处理好的717强碱性苯乙烯性阴离子交换树脂,流出液室温下泵入第一级微通道反应器中,同时泵入甲基异丁基酮(150g,1 .5mol), 进行反应,反应温度控制在40 ?60℃;第一级微通道反应器流出液直接进入第二级微通道反 应器中,并同时加入1,3 ?二氯丙烯(116 .6g,1 .05mol)、30%氢氧化钠(147g,1 .1mol)溶液, 继续反应,反应温度控制在50 ?70℃;反应结束后,分相,水相用甲基异丁基酮萃取(50mL× 3),合并有机相和萃取相,水洗后共沸除水,回收溶剂,得到O ? (3 ?氯 ?2 ?丙烯基)羟胺产品 102.1g。
[0068] 本实施例制得的O ? (3 ?氯 ?2 ?丙烯基)羟胺纯度为99.1%,收率为94.2%。
[0069] 综上所述,使用本发明工艺制备O ? (3 ?氯 ?2 ?丙烯基)羟胺,能够得到高收率、高含 量的目标产物,原料消耗低,能大幅降低生产成本,还能大幅度减少三废中废水的产生,是 一种高效环保的O ? (3 ?氯 ?2 ?丙烯基)羟胺生产方法。
[0070] 本发明的合成方法使用碱性离子交换树脂将羟胺盐水溶液处理得到羟胺溶液,能 有效减少废水中盐的含量,降低废水处理成本;本发明使用甲基异丁基酮与羟胺反应,甲基 异丁基酮同时作为氨基保护剂和溶剂,反应前后分子结构未发生变化,能克服传统工艺消 耗大量乙酸乙酯并副产醋酸和氯化钠的缺点;本发明使用共沸除水工艺,不使用干燥剂除 水,因此不产生固废;本发明使用微通道反应代替传统釜式或管式反应器,能进一步提高产 品收率和品质。
[0071] 综上所述,本发明是一种高效、环保、高收率的O ? (3 ?氯 ?2 ?丙烯基)羟胺合成方法,适合于工业化生产。
[0072] 上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟 悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因 此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完 成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
下一篇:一种3-羟基丙酸的制备方法
上一篇:一种D,L-泛酸内酯的合成方法